こんにちは!
chem(ケム)です!
「ハーバー法ってなんだっけ?」
「ハーバー・ボッシュ法ちょっと覚えてないかも」
そんなあなた!
大丈夫です!
忘れているなら覚え直して定着させちゃいましょう!
なので
今回は
を紹介していきます!
ハーバー・ボッシュ法って何?
まず、
ハーバー・ボッシュ法は工業的製法で重要な製法なんです!
窒素が空気中に窒素分子の形で含まれているとき、
窒素は不活性であまり役には立っていません。
ところが、より反応性の高いアンモニアなどの形では、
がぜん優れた肥料となります。

これを第一次世界大戦の少し前、
フリッツ・ハーバー(左)とカール・ボッシュ(右)が空気中の窒素を
アンモニアに変える実用的な方法を発見しました。

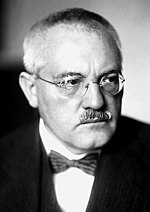
これが、「ハーバー・ボッシュ法」です。
これは人類史上屈指の重要な発見とされ、
アンモニア肥料は今や世界の3分の1にを養っています。
ハーバー・ボッシュ法の原理
ハーバー・ボッシュ法を理解するためには
「化学平衡」を理解しておく必要があります。
**ここからは化学平衡を理解いてからご覧ください**
ハーバー・ボッシュ法は以下の平衡反応のように
水素と窒素からアンモニアを作ります。
この方法は鉄を主体とした
触媒を用いながら高温・高圧下で次の反応を進めています。
N2+3H2⇄2NH3+92 kJ
この平衡反応は普通なら、
NH3の生成反応は発熱反応かつ気体粒子数減少反応ですから、
ルシャトリエの原理からすれば、
NH3の製造には低温・高圧の条件がいいように思えます。
ではなぜ高温・高圧にするのでしょうか?
高温・高圧の理由
①高圧下で反応させているのは…
平衡時のNH3の収率を上げるためです!
これは化学平衡の原理からわかりますね。
②では、なぜ高温下で反応させるのだろう?
これは確かに低温のほうが
平衡時のNH3の収率は高くなりますが、
温度が低すぎると、
反応速度が遅くなって、
平衡に達するまでに時間がかかるからなのです。
つまり、
高温下で反応させているのは、
反応速度を大きくし、
平衡に早く到達させるためです。
ゆっくりたくさんできるより、
少しずつでも早くできる方が
結果的に収量が多くなるのです。
先にも言いましたが、
これは鉄を主体とした触媒Fe3O4がこの反応のキモなんです!
こればっかりは覚えるしかないので、
この触媒は重要なので必ず覚えてください!
平衡を進めながら反応速度を上げるために、
Fe3O4を触媒に用いるところがキモでした。
歴史で反応を学ぶと少し面白くなってきますね。
最後までご覧いただき
ありがとうございました。